Beschreibung von HGE-Verbindungen
Beschreibung von Hauptgruppenelementverbindungen
Untersuchung von Reaktionsmechanismen
| Das schnell wachsende Gebiet der Hauptgruppenchemie bringt immer mehr Moleküle und Verbindungen hervor, die in Bezug auf ihre katalytische Aktivität mit Übergangsmetallen konkurrieren. [1] Während die Reaktionsmechanismen der letzteren größtenteils gut verstanden sind, sind bei hochreaktiven Verbindungen der Hauptgruppenelemente oft noch die genauen Abläufe der zugrunde liegenden katalytischen Zyklen unklar. In einem Beispiel aus unserer Arbeit verwenden wir die Dichtefunktionaltheorie, erweitert um thermochemische Korrekturen, um die Hydroborierung über ein reduziertes Diboraanthracen-Derivat als Fallstudie zu untersuchen. Freie Energieberechnungen haben gezeigt, dass die Einbeziehung des Gegenions sowie der Effekte des impliziten und expliziten Lösungsmittels notwendig ist, um verfügbare experimentelle Daten (z. B. in Kristallen gefundene Geometrien, Abbildung 1) zu reproduzieren und ein umfassendes Bild des energetischen Profils für diese Reaktion zu erhalten, das von den Gegenionen des Katalysators abhängt (Abbildung 2). Diese Arbeit wird in Zusammenarbeit mit der Wagner-Gruppe (Goethe-Universität Frankfurt) durchgeführt, die die Synthese und die experimentellen Messungen durchführt. [2] |
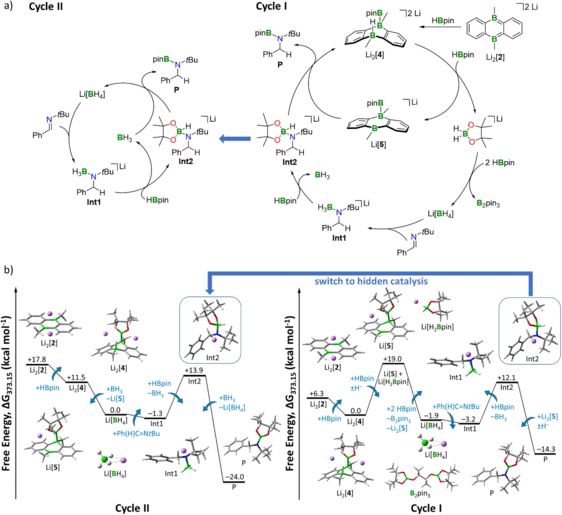
Abbildung 2: (a) (Rechts) Katalysezyklus I (Hydrid-Shuttle: Li[H2Bpin]). (Links) Katalysezyklus II, versteckte Katalyse (Hydrid-Shuttle: Li[BH4]). (b) (Rechts) Gibbs-Energie-Diagramm für den katalytischen Zyklus I. (Links) Gibbs-Energie-Diagramm für den versteckten Katalysezyklus II, einschließlich BH3·thf/Li[BH4]. Die Energien sind auf den Ausgangspunkt des jeweiligen Zyklus bezogen. Verwendete Methode: SMD(Lösungsmittel = THF)/ωB97XD/6-311++G(d,p) basierend auf optimierten Strukturen bei SMD(Lösungsmittel = THF)/ωB97XD/6-31+G(d,p). Zur besseren Übersicht wurden explizite THF-Moleküle weggelassen.
[1] Nitrogen fixation and reduction at boron. M.-A. Légaré, G. Bélanger-Chabot, R. D. Dewhurst, E. Welz, I. Krummenacher, B. Engels, H. Braunschweig, Science 2018, 359, 896–900, http://doi.org/10.1126/science.aaq1684.
[2] Multifaceted behavior of a doubly reduced arylborane in B–H-bond activation and hydroboration catalysis. S. E. Prey, C. Herok, F. Fantuzzi, M. Bolte, H.-W. Lerner, B. Engels, M. Wagner, Chem. Sci. 2022, 14, 849-860, https://doi.org/10.1039/D2SC05518J.