Einblicke in die Funktionsweise eines Ribozyms
17.03.2022Die Kristallstruktur des Methyltransferase-Ribozyms MTR1 zeigt die erstaunliche Architektur der Bindungsstasche für den Cofaktor und einen unerwarteten Mechanismus der Methylgruppenübertragung.
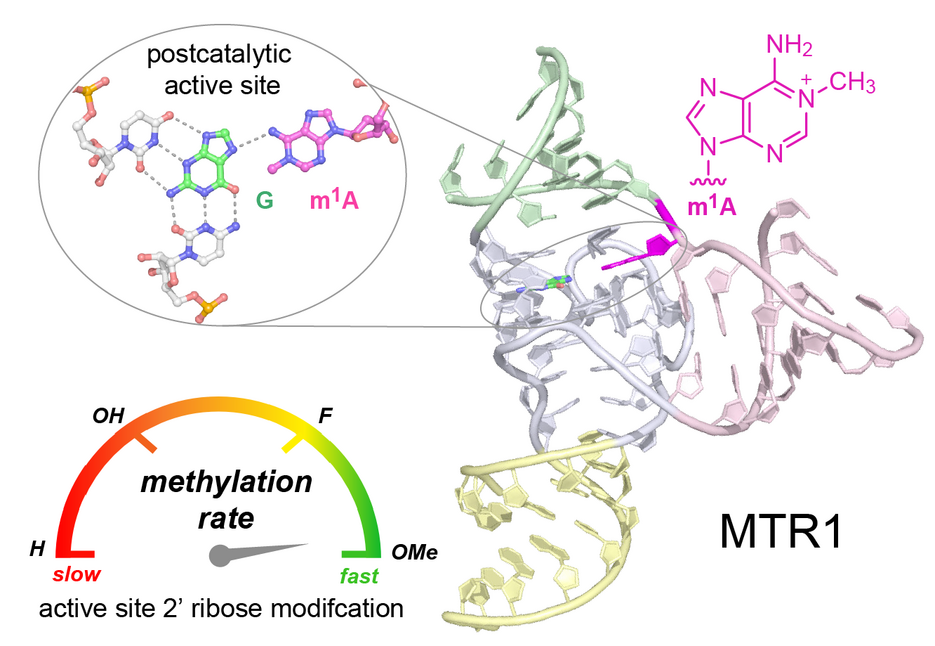
Neben Proteinen haben auch Ribonukleinsäuren (RNAs) die Fähigkeit bestimmte Reaktionen zu katalysieren. Solche katalytisch aktiven RNAs werden auch Ribozyme genannt. Kürzlich wurde von unserer Arbeitsgruppe ein Ribozym beschrieben, das hoch spezifisch eine kleine chemische Modifikation, genauer gesagt eine einzelne Methyl-Gruppe an einer genau definierten Stelle in einer anderen RNA anbringen kann. Damit war dies das erste bekannte Methyltransferase-Ribozym, was ihm den Namen MTR1 einbrachte. Nun gelang es unserer Arbeitsgruppe die Struktur von MTR1 und den zugrunde liegenden Mechanismus dieser RNA-katalysierten Reaktion aufzuklären.
Hierfür wurde das Ribozym zusammen mit der Ziel-RNA und O6-Methylguanin als Cofaktor kristallisiert. Die Analyse der Kristallstruktur ergab, dass die Methylgruppe vollständig auf die RNA übertragen wurde, und im Kristall der post-katalytische Zustand festgehalten wurde. Aus der Anordnung der Nucleotide und der Bindung des abreagierten Cofaktors ließ sich direkt der katalytische Mechanismus ableiten, der durch die Ergebnisse zahlreicher biochemischer Experimenten untermauert wurde. Dabei spielt eine protonierte Nucleobase eine entscheidende Rolle. Außerdem weist die Bindungstasche erstaunliche Ähnlichkeiten zur Substratbindestelle in sogenannten Purin-Riboschaltern auf. Dies sind natürlich vorkommende RNA-Abschnitte, welche kleine Moleküle binden und als eine Art An- bzw. Aus-Schalter von Genen fungieren.
Des Weiteren konnten wir anhand der Struktur zwei Positionen in der aktiven Tasche des MTR1 Ribozyms identifizieren, welche für die katalytische Aktivität essentiell sind. Durch Anbringen von je einer kleinen chemischen Veränderung an genau diesen beiden Stellen konnte die Ribozymaktivität um mehr als das Zehnfache gesteigert werden.
Einen derart stark beschleunigenden Effekt nur durch das Anbringen von zwei strategisch positionierten Methylgruppen konnte bislang noch für keine andere katalytisch aktive DNA oder RNA beobachtet werden. Zusammen mit der überraschenden Ähnlichkeit zwischen unserem im Labor evolvierten MTR1 und in der Natur vorkommenden RNA-Motiven sind unsere Ergebnisse eine wichtige Stütze der sogenannten RNA-Welt-Hypothese. Diese postuliert, dass RNA zu einem der ersten Informations-speichernden sowie katalytisch aktiven Polymeren gehört hat. In einem solchen Zeitalter könnte die Aktivität der ersten Enzyme ebenso durch das Anbringen einfacher Modifikationen stark gesteigert worden sein. Zudem deutet unsere Forschung darauf hin, dass heutige Riboschalter potentiell Überreste früherer Ribozyme darstellen könnten, die über die Zeit ihre katalytische Aktivität verloren haben.
Diese Erkenntnisse legen nahe, dass durch das Anbringen kleiner chemischer Veränderungen auch die Aktivität von anderen Ribozymen gesteigert werden könnte. Auch ist es denkbar, dass RNA mit modifizierten Basen noch zahlreiche weitere Reaktionen katalysiert kann, für die bisher noch keine Ribozyme gefunden wurden. Zukünftige Projekte werden daher versuchen solche katalytischen RNAs zu finden, und damit das Spektrum an Ribozymen und RNA-katalysierten Reaktionen zu erweitern.
Carolin Scheitl & Claudia Höbartner
Originalpublikation: Structure and mechanism of the methyltransferase ribozyme MTR1. C.P.M. Scheitl, M. Mieczkowski, H. Schindelin, C. Höbartner, Nat. Chem. Biol. 2022, first published March 17, 2022
Gleichzeitig wurde die Struktur des MTR1 Ribozyms von Lilley & Huang berichtet. Die Erkenntnisse aus beiden Arbeiten wurden im News & Views-Artikel von Hiller & Strobel zusammengefasst: "A New RNA performs old chemistry"